|
Cuando el carbonato de calcio
reacciona en un recipiente cerrado con ácido
clorhídrico se desprende dióxido de carbono
(fácilmente visible por las burbujas generadas) y se
establece el siguiente equilibrio:
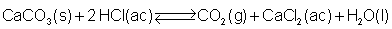
Al haber distinto número de moles
gaseosos en uno y otro miembro (el CO2 es
el único compuesto gaseoso) podremos desplazar
el equilibrio variando la presión.
En el vídeo se muestra el montaje
utilizado con este fin: un trozo de carbonato
cálcico (mármol) se introduce en un tubo de ensayo
(grande) al que se añadirá posteriormente ácido
clorhídrico (0,1 M). El tubo se tapa (es conveniente
asegurar el corcho con cinta adhesiva) y se conecta
con una jeringuilla. Desplazando el émbolo podremos
aumentar o disminuir la presión del sistema a
nuestra voluntad.
Según el principio de Le Chatelier
al
aumentar la presión sobre el sistema el equilibrio
se desplazará en el sentido de anular la
perturbación producida, por lo que el sistema
evolucionará hacia una nueva posición de equilibrio
relajando la presión, lo que se consigue mediante
una disminución en el número de moles gaseosos. En el vídeo
puede verse como cuando aumenta la presión (el émbolo desciende), se reduce
la producción de CO2, ya que el
equilibrio se desplaza hacia la izquierda.
Por el contrario, cuando se disminuye
la presión (el émbolo asciende), es evidente
un
aumento de la cantidad de CO2 generado,
el equilibrio se desplaza entonces hacia la derecha
con el fin de aumentar el número de moles gaseosos
para originar una elevación de la presión. |