|
Los tres laureados en química para 2009, Ada E.
Yonath, Thomas A. Steitz y Venkatraman Ramakrishnan,
son recompensados por la detallada descripción de los
ribosomas (una estructuras de gran complejidad) a escala
atómica. Los ribosomas leen la información del ARN
mensajero y, en función de esa información, fabrican
proteínas. Los científicos se refieren a este proceso como
la traducción. Es durante este proceso de
traducción cuando la información contenida en el ADN/ARN
se convierte en proteínas, cuando la vida alcanza toda su
complejidad.
A menudo un descubrimiento innovador proviene de un
pionero que investiga territorios inexplorados. En este
caso esa pionera fue Ada Yonath. Al final
de la década de 1970 decidió intentar generar estructuras
cristalográficas de rayos X de los ribosomas. En ese
momento, sin embargo, la mayoría de las personas
consideraban que esto era imposible.
En la cristalografía de rayos X los científicos hacen
incidir rayos X en un cristal de, por ejemplo, una
proteína (ver figura). Cuando los rayos golpean los átomos
del cristal son dispersados registrándose el resultado de
esa dispersión. Anteriormente esto se lograba mediante una
película fotográfica que era impresionada por los rayos
X. Hoy en día se utilizan detectores CCD, los mismos que
pueden encontrarse en las cámaras digitales (y que han
sido objeto del Nobel de Física 2009). Analizando el
patrón de dispersión obtenido, los científicos pueden
determinar cómo están colocados los átomos en una
proteína.
|
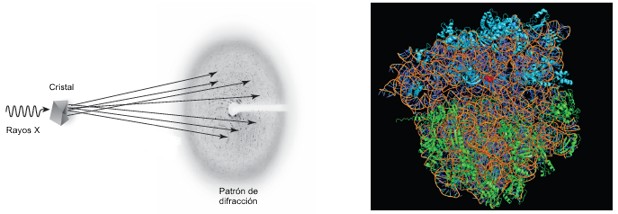
Los
rayos X empleados se obtienen a partir de sincrotrones
en los cuales los electrones son acelerados hasta
velocidades próximas a las de la luz. Cuando los rayos
X inciden sobre un cristal son dispersados,
produciendo millones de puntos en un detector CCD.
Analizando este patrón los investigadores pueden
determinar la posición de cada átomo en el ribosoma.
Se requiere un software especial para visualizar el
ribosoma (foto de la derecha) |
Para que esto funcione el cristal tiene que ser casi
perfecto, las moléculas deben de formar un patrón
preciso que se repita una y otra vez.
Muchas
personas veían con escepticismo el trabajo de Ada
Yonath. Los ribosomas son uno de los complejos
proteína/RNA más complicados. Ada Yonath pretendía
establecer la ubicación exacta de todos y cada uno de
estos átomos en los ribosomas.
Cuando decidió cristalizar los ribosomas se puso a
trabajar con bacterias que viven bajo condiciones muy
duras. |
El
Geobacillus stearothermophilus puede vivir en
manantiales calientes y sobrevive a temperaturas de hasta
75 °C. La hipótesis con la que trabajaba Ada Yonath era
que, para poder soportar estas condiciones, sus ribosomas
deberían de ser extremadamente estables, por lo que la
posibilidad de obtener con ellos unos buenos cristales
era alta.
En
1980 ya había conseguido generar los primeros cristales
tridimensionales de los ribosomas. Este fue un gran logro,
aunque los cristales distaban bastante de ser perfectos.
En
realidad restaban 20 años de duro trabajo antes de que
Ada Yonath fuera capaz de generar una imagen de los
ribosomas en la que se pudiera determinar la ubicación de
cada átomo. Intentó muchas cosas nuevas. Por ejemplo,
estabilizó los cristales congelándolos en nitrógeno
líquido (a -196 ° C). También trató de cristalizar los
ribosomas de otros microorganismos resistentes. Uno de
ellos el Haloarcula marismortui , un gran amante
de la sal, que vive en el Mar Muerto. |